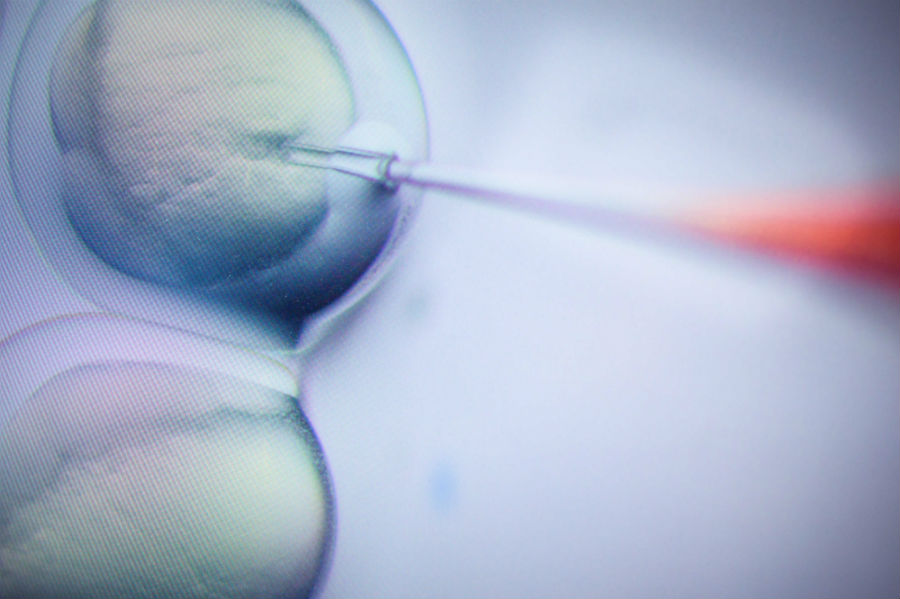
В июне журнал Nature Medicine опубликовал исследования Каролинского института и Института биомедицинских исследований Novartis, которые заявляли: геномный редактор Crispr/Cas9 может вызвать рак. Это плохо отразилось и на рыночных котировках публичных компаний, ведущих разработки в этом направлении, и на обществе, уже привыкшем воспринимать Crispr/Cas9 как волшебную палочку, способную излечить все болезни.
«Такие дела» узнали у экспертов, действительно ли Crispr/Cas9 вызывает рак и почему это не повод для паники.
«Ученые показали очевидное»
Crispr/Cas9 не раз сравнивали с ножницами: геномный редактор разрезает ДНК в двух местах и, в зависимости от целей ученых, либо вырезает оттуда «неправильный» участок, либо вставляет «правильный» — чтобы клетки, исправляя повреждение ДНК, ориентировались на него как на образец.
Репарация — способность клетки исправлять повреждение ДНК — происходит благодаря белку p53. Он работает как сигнализация в сейфе: активируется при повреждении, останавливает клеточный цикл и связывается с группой генов, которые запускают репарационный синтез ДНК. В случае если повреждение слишком сильное, то p53 запускает механизм запрограммированной клеточной смерти.
Такие повреждения ДНК происходят постоянно, объясняет заведующий лабораторией геномной инженерии МФТИ Павел Волчков: и из-за воздействия окружающей среды (того же ультрафиолета), и из-за нормальных метаболических процессов самой клетки. Но бывают генетические мутации, из-за которых p53 не выполняет свою нормальную функцию, — и это позволяет раковым клеткам обходить «сигнализацию» клетки и продолжать делиться. Согласно исследованиям, у половины всех раковых процессов инактивирован p53.
Вмешательство геномного редактора — это то же самое повреждение ДНК. Нормально реагирующий p53 не даст поврежденному участку остаться без репарации и запустит смерть клетки, если провести ее «правильно» окажется невозможно. Те клетки, в которых инактивирован p53, получат преимущество: их клеточный цикл не остановится, то есть будут размножаться преимущественно те клетки, в которых p53 не функционален. Это значит, что «сигнализация» не может противостоять распространению рака.
«Ученые показали очевидное, — подчеркивает Волчков. — На мой взгляд, достаточно понятная догма, что, скорее всего, при использовании Cas-инструментов будут собираться те клетки, у которых есть инактивирующая мутация в p53. Но это не значит, что мы, выполняя ту или иную процедуру по редактированию генома, не знаем об этой вероятности. В статьях не показан важный нюанс: эффективная генетическая рекомбинация (процесс обмена генетическим материалом путем разрыва и соединения разных молекул. — Прим. ТД) без p53 также невозможна. Иными словами, для редактирования нам нужно, чтобы p53 вмешался и заставил клетки использовать механизм рекомбинации для репарации, именно таким образом мы можем редактировать определенные места в геноме. Зная об этом, мы проверяем после редактирования, все ли произошло правильным образом».
Любая генная терапия вызывает необратимые изменения в геноме пациента, которую не отменишь, как прием таблеток, напоминает генеральный директор компании Genotek Валерий Ильинский. Это и есть причина того, почему технологии генома проходят намного больше этапов тестирования, чем таблетки, до перехода к клиническим испытаниям.
«Действительно, Crispr/Cas9 может совершать ошибки, вызывая в качестве побочных эффектов генетические нарушения, приводящие в том числе и к онкологическим заболеваниям. Однако очевидно, что в ряде случаев возможные риски все же ниже пользы — например, в случае наследственных заболеваний в жизнеугрожающей фазе, для которых не существует альтернативной терапии», — заключает он.
Настоящий редактор
Через пять — десять лет ученые и врачи изучат возможности и недостатки различных методов редактирования генома и они станут обычными медицинскими технологиями, со своими плюсами и минусами, прогнозирует Ильинский.
Сейчас генная инженерия создает более специфичные инструменты, которые не разрезают две цепочки ДНК, а вносят точечные изменения безо всяких разрывов. Все равно что вместо ножниц использовать карандаш — и вместо того чтобы вырезать из кусочков слова и вставлять в предложение, вносить исправления карандашом, поясняет Волчков. Инструменты позволяют подставить на нужное место ферменты, модифицирующие участок ДНК.
«Таким образом можно делать точечные нуклеотические замены: если у человека есть какая-нибудь патогенная генетическая мутация, мы можем один нуклеотид заменить, не производя вообще никаких разрывов цепочки ДНК, — говорит он, добавляя, что это всего лишь одно из направлений генной инженерии. — Это уже так называемый геномный редактор в чистом значении слова “редактировать”, не удаляя кусок, а меняя непосредственно нуклеотид на другой».
Такой инструмент не увеличивает риск развития рака, потому что при этом способе не происходит селекции клеток на поломанный p53.
Однако до тех пор пока геномные редакторы не вошли в обиход, судьбу технологий решают обычные люди, на которых действуют яркие заголовки и всеобщая паника.